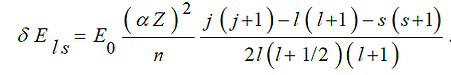6В05302 Химия
О. Дрюк / А. Мунарбаева
Спектры атомов
Цель: проанализировать основные характеристики атомных спектров
План:
1. Характеристики спектральных линий: положение, ширина и интенсивность
2. Энергетические переходы. Разрешенные и запрещенные переходы. Правила отбора
1. Характеристики спектральных линий: положение, ширина и интенсивность
Методы атомной спектроскопии основаны на явлениях поглощения и испускания света свободными атомами, а также их люминесценции. Спектры индивидуальных атомов можно наблюдать только в газовой фазе при относительно небольших давлениях. Для перевода вещества в атомное состояние и его возбуждения чаще всего используется нагрев до высоких температур. При этом возможно возникновение спектров трех типов: непрерывных (или сплошных), полосатых и линейчатых. Излучение непрерывного спектра испускается нагретыми твердыми телами. Полосатые спектры типичны для молекул, находящихся при высокой температуре – CN, СН, С2, SrOH. Эти спектры отражают сложные процессы, связанные с изменением электронной, колебательной и вращательной энергии молекул. Линейчатые спектры обусловлены процессами возбуждения электронов свободных атомов и одноатомных ионов.
Классификация спектров. В зависимости от типа взаимодействия излучения с веществом различают спектры испускания и спектры поглощения. Спектры испускания обусловлены переходами, при которых Ei > Ej.
Виды спектров испускания:
- эмиссионные спектры – испускаются термически возбуждёнными частицами;
- спектры люминесценции - испускаются не термически возбуждёнными частицами (под действием энергии электромагнитного излучения, электрического поля, энергии химической реакции и др.).
По положению характерных линий в спектре можно определить элементный состав (качественный
анализ), а по относительным величинам интенсивностей линий в спектрах испускания или величинам оптической плотности линий в спектрах поглощения – концентрации элементов в анализируемой смеси (количественный анализ). Cпектральные линии, характеризуют частотой излучения v, которая соответствует квантовому переходу между уровнями энергии Ei и Ek атома согласно соотношению:
где h-постоянная Планка.
Излучение (поглощение) квантов связано с переходом электрона между возбужденными состояниями. Спектральные линии можно характеризовать также длиной волны λ = c/v (с - скорость света), волновым числом 1/λ = v/c и энергией фотона hv. Частоты спектральных линий выражают в с-1, длины волн-в нм и мкм, а также в А, волновые числа - в см -1, энергии фотонов - в эВ. Наиболее интенсивны линии, соответствующие переходам с основного уровня (поглощение, абсорбция) или на основной уровень (излучение, эмиссия) – резонансные линии.
Коэффициент, равный отношению числа фотонов νnm (индекс m для нижнего электронного уровня, n – для верхнего), спонтанно испущенных за единицу времени, к числу частиц, находящихся в возбужденном состоянии Nn, называют вероятностью спонтанного излучения, или коэффициентом Эйнштейна (А) для спонтанного испускания. Символом Аnm обозначают коэффициент Эйнштейна для перехода системы из состояния с энергией Еn в состояние с энергией Еm. Интенсивность спектральной линии Inm, соответствующей спонтанному переходу с уровня n на уровень m, равна:
Величину отношения числа фотонов νmn, поглощенных в единицу времени, к числу частиц Nm с энергией Еn на единицу плотности излучения р (νmn), называют коэффициентом Эйнштейна для поглощения Bmn. Произведение Вmn р (νmn), пропорциональное доле частиц, поглощающих фотоны частоты νmn, называют вероятностью поглощения. Интенсивность линии в спектре поглощения зависит не только от числа поглощающих излучение частиц (заселенности уровня m), вероятности перехода при поглощении Вmn, но и от числа падающих фотонов:
Атомы каждого элемента в определенных условиях образуют характерный линейчатый спектр поглощения или излучения. Не существует двух таких элементов, которые имели бы тождественные системы линий в атомном спектре. Каждому элементу соответствует свой спектр нейтрального атома (дуговой спектр) и свои спектры последовательно образующихся положит. ионов (искровые спектры). Линии в этих спектрах обозначают римскими цифрами, напр. линии PeI, FeII, FeIII в спектрах железа соответствуют спектрам Fe, Fe+, Fe2+.
Вид спектра зависит как от электронного строения данного атома, так и от внешних условий - температуры, давления, напряженностей электрических и магнитных полей и т. п. В зависимости от способа возбуждения атома могут возникать отдельные линии спектра, некоторые его участки, весь спектр нейтрального атома или его иона определенной кратности. Положение линий в таких спектрах подчиняется определенным закономерностям. В спектрах атомов наблюдаются спектральные серии, каждая из которых (в случае спектров испускания) получается при возможных квантовых переходах с последовательных вышележащих уровней энергии на один и тот же нижележащий (в спектрах поглощения - при обратных переходах). Промежутки между линиями одной серии убывают в сторону больших частот, т.е. линии сходятся к границе серии - максимальной для данной серии частоте, соответствующей ионизации атома. Для атома Н волновые числа линий всех серий определяются обобщенной формулой Бальмера:
Где nk и ni - значения главного квантового числа для уровней энергии, между которыми происходит квантовый переход, причем nk, характеризующее нижний уровень энергии, определяет серию, а ni - ее отдельные линии (при получается граница серии);
R-постоянная Ридберга.
Спектры атомов щелочных металлов, имеющих один электрон на внешней электронной оболочке, схожи со спектром Н, но смещены в область меньших частот; число спектральных линий в них увеличивается, а закономерности в расположении линий усложняются. Пример - спектр Na, атом которого имеет электронную конфигурацию Is22s22p63s с легковозбуждаемым внеш. электроном 3s. Переходу этого электрона из состояния Зр в состояние 3S соответствует желтая линия Na (дублет λ = 589,0 нм и λ = 589,6 нм); это - наиболее яркая линия, с которой начинается главная серия Na. Линии этой серии в спектре испускания соответствуют переходам из состояний Зр, 4р, 5р> ... в состояние 3S.
Для атомов последних групп элементов в периодической системе, обладающих двумя или несколькими внешними электронами, спектры еще более усложняются, что обусловлено взаимодействием электронов. Особенно сложны спектры атомов с заполняющимися d- и f-оболочками; число линий в таких спектрах достигает несколько тысяч, простых закономерностей в них не обнаруживается. Однако и для сложных спектров можно произвести систематику оптических квантовых переходов и определить схему уровней энергии. Систематика спектров атомов с двумя и более внешними электронами основана на приближенной характеристике отдельных электронов при помощи квантовых чисел n и l с учетом взаимодействия этих электронов друг с другом. При этом приходится учитывать как их электростатическое взаимодействие, так и спин-орбитальное, что приводит к расщеплению уровней энергии. В результате этого взаимодействия у большинства атомов каждая спектральная линия представляет собой более или менее тесную группу линий - мультиплет. Так, у всех щелочных металлов наблюдаются двойные линии (дублеты), причем расстояния между линиями увеличиваются с увеличением порядкового номера элемента. Для щелочно-земельных элементов наблюдаются одиночные линии (синглеты) и тройные (триплеты). В спектрах атомов последней групп периодической системы элементов наблюдаются еще более сложные мультиплеты, причем атомам с нечетным числом электронов соответствуют четные мультиплеты (дублеты, квартеты), а с четным числом - нечетные (триплеты, квинтеты). Кроме тонкой структуры в А. с. наблюдается также сверхтонкая структура линий (примерно в 1000 раз уже, чем мультиплетная), обусловленная взаимодействием электронов с магнитным и электрическими моментами ядра.
Под влиянием внеш. электрических и магнитных полей происходит расщепление спектральных линий. Возмущающие факторы, существующие в излучающей среде, вызывают уширение и сдвиг спектральных линий.
Подробнее структуру спектров рассмотрим через вероятность переходов (второй вопрос лекции).
Спектральные линии имеют различную форму и разную ширину, что обусловлено свойствами самой излучающей или поглощающей системы и внешними условиями (температура, давление). На ширину влияет и размер входной щели регистрирующего спектрометра – щель не может быть бесконечно узкой, поэтому на детектор всегда попадают набор фотонов в некотором диапазоне частот. Контуром, или профилем спектральной линии называют распределение интенсивности линии в зависимости от длины волны или волнового числа (частоты). Контур реальной спектральной линии - колоколообразная кривая с максимумом. Под шириной линии обычно подразумевают разность частот или длин волн, соответствующую половине максимальной интенсивности. Естественная ширина линии связана с неопределенностью в величине энергии состояния атома. Энергия атома может быть известна лишь с точностью ΔW, связанной со временем жизни τ состояния соотношением неопределенности:
Естественная ширина спектральной линии:
где m – масса колеблющейся атома (молекулы), v – частота колебаний.
В видимой области спектра естественная ширина спектральных линий составляет 10-20 МГц (10-5 нм).
Допплеровское уширение спектральных линий появляется из-за теплового движения атомов в плазме. Атомы, движущиеся в направлении распространения излучения, поглощают при более низких частотах, а движущиеся навстречу излучению – при более высоких. В результате возникает симметричное уширение спектральной линии.
Частота излучения атома, движущегося по оси z, смещена относительно частоты излучения неподвижного атома v на величину:
Допплеровское уширение спектральной линии:
где μ – атомный вес ансамбля излучающих частиц.
При высоких температурах допплеровская ширина линий легких элементов велика. Так, допплеровская ширина водородной линии Hβ (λ = 486,1 нм) при 5000 K составляет 0,025 нм. Самым тяжелым элементом, используемым в источниках света, является ртуть (μ = 200). В видимой области спектра при Т = 5000 K линии ртути имеют допплеровскую ширину порядка 10-3 нм. Допплеровская ширина линии, как правило, на два порядка превышает естественную ширину. Лоренцевское уширение вызвано взаимодействием между излучающими или поглощающими частицами и посторонним газом. При столкновении частиц их энергетические уровни расщепляются, изменяется фаза колебаний и время жизни возбужденного состояния. Это приводит к уширению спектральных линий.
Для лоренцевского уширения линий характерны закономерности:
1. Рост давления увеличивает ширину, сдвигает максимум относительно исходного положения и формирует асимметрию контура. Для конденсированных сред, из-за сильных межмолекулярных взаимодействий, уширение достигает 10 нм.
2. Изменение полуширины линии и сдвиг максимума пропорциональны давлению постороннего газа.
3. Различные газы имеют различную способностью к уширению и сдвигу линий.
Лоренцевское уширение может быть определено из уравнения:
где p – давление газа (в барах), σ – эффективное сечение столкновения (в см2), λ –длина волны в см, μ – атомный вес излучающей частицы.
Спектральная линия при столкновениях уширяется несимметрично, происходит ее смещение, пропорциональное давлению. Так, резонансная линия натрия λ=589,0 нм при давлении азота, равном 10 мм рт. ст., имеет лоренцовскую ширину ΔλL=0,00018 нм и смещение 0,00007 нм (160 и 63 МГц). При атмосферном давлении азота ширина этой линии составляет 0,014 нм, а смещение - 0,005 нм (12,0 и 4,8 ГГц).
Доплеровский и лоренцевский контуры различны по форме.
Если оба фактора действуют одновременно, то центр линии определяется в основном доплеровским, а края – лоренцевским уширением. При столкновениях однородных частиц между ними возникает сильная резонансная связь и происходит перераспределение энергии от излучающего атома к невозбужденному. Колебания излучающего атома ослабляются, что приводит к расширению линий.
Резонансное уширение спектральной линии:
где е и Т – заряд и масса электрона, p – давление, f – сила осциллятора.
Наибольшее резонансное уширение наблюдается на резонансных линиях, так как для них силы осцилляторов наиболее велики. Резонансное уширение линий обычно несимметрично. Уширение, вызванное резонансными взаимодействиями, в десятки и более раз превышает уширение, обусловленное посторонними атомами при том же давлении. Например, при давлениях меньше 10 мм рт. ст. резонансная ширина линий может доходить до 0,002 нм (при λ = 500 нм). Штарковское уширение линий связано с тем, что под действием электрического поля в плазме энергетические уровни атомов расщепляются, и линии приобретают сложную структуру, зависящую от природы уровней и величины поля. Если электрическое поле в плазме неоднородно, в различных точках плазмы штарковское расщепление уровней оказывается различным, в результате чего линия приобретает сложный вид.
Если излучающий элемент находится в магнитном поле, то его энергетические уровни расщепляются на ряд подуровней. Возникает уширение, определяемое эффектом Зеемана, пропорциональное величине магнитного поля.
Важным фактором, определяющим контур спектральной линии, является реабсорбция излучения. Квант света, испущенный возбужденным атомом (ионом, молекулой) может до выхода из среды поглотиться таким же атомом, который находится в более низком энергетическом состоянии. При увеличении концентрации атомов число поглощаемых и теряемых таким образом квантов вырастает быстрее, чем число испускаемых квантов. Интенсивность линии растет медленнее, чем концентрация атомов в плазме. Линия при самопоглощении уширяется, а максимум ее снижается. Меньше других подвергаются самопоглощению и самообращению линии ионов.
Контур линии, испытывающей самопоглощение
2. Энергетические переходы. Разрешенные и запрещенные переходы. Правила отбора.
Структура спектра элемента определяется возможными значениями внутренней энергии его атомов. Каждому состоянию электрона соответствует определенная внутренняя энергия атома, определенный энергетический уровень. Поэтому переход электрона из одного возможного состояния в другое сопровождается соответствующим изменением энергетического уровня атома. Внутренняя энергия атома может изменяться только дискретно. Спектр атома водорода отличается относительной простотой. Энергия электрона в атоме водорода зависит только от силы взаимодействия его с ядром и характеризуется значением главного квантового числа п. Самый нижний уровень Е0 отвечает невозбужденному состоянию атома, когда электрон находится на ближайшем из возможных расстояний от ядра (n = 1) и наиболее прочно с ним связан.
Структура уровней и спектр атома водорода: a – главная, б – побочная серия
При возбуждении электрон, принимая извне дополнительную энергию, удаляется от ядра, переходя из состояния с n = 1 в состояние с n = 2, 3, 4, 5, 6,... Самый верхний уровень отвечает энергии, которую надо сообщить атому для отрыва от него электрона – энергия (потенциал) ионизации. Линии, имеющие одинаковую энергию возбуждения, называют гомологичными. Гомологичные линии одного элемента имеют одинаковый верхний уровень и разные нижние. Все линии в спектре водорода отчетливо группируются в серии. У линий одной серии один и тот же нижний уровень и разные верхние. Линии с нулевым нижним уровнем составляют главную серию. Остальные серии линии, для которых нижним является второй, третий, четвертый и другие уровни, называют побочными сериями. Спектральная серия возникает при разрешенных излучательных квантовых переходах с различных возбужденных уровней энергии n’ на один и тот же конечный уровень n (n < n’) и сходится к границе серии при
Теория Бора дает следующее выражение для частоты спектральной линии атома водорода
где – постоянная Планка,
– циклическая частота излучения,
En’, En –верхний и нижний уровни энергии,
m, e – масса и заряд электрона.
Тонкую структуру энергетических уровней атома водорода порождают два физических (релятивистских) фактора:
1) релятивистский эффект зависимости массы электрона от скорости его движения вокруг атомного ядра;
2) взаимодействие собственного магнитного момента электрона с магнитным полем, индуцируемым в системе координат электрона при его движении в электростатическом поле ядра.
Последний фактор, связанный со спином электрона и его орбитальным движением также обладает релятивистской природой.
Величина релятивистской поправки к энергетическому уровню (формулу Зоммерфельда):
Ry - постоянная Ридберга.
Постоянная тонкой структуры определяет масштаб релятивистской энергетической поправки, сдвигающей уровни атома вниз на величину:
Учет спин-орбитального взаимодействия приведет к качественно иному результату – расщеплению уровней. Механизм спин-орбитального взаимодействия обусловлен наличием у электрона магнитного спинового момента связанного с механическим спиновым моментом импульса. Собственный (спиновый) магнитный момент электрона направлен противоположно механическому и равен:
где S– механический спиновый момент импульса, множитель 2, выражающий аномальные гиромагнитные свойства спина, является эмпирическим фактором (гиромагнитный фактор для орбитального движения равен 1).
Выражение для энергии спин-орбитального взаимодействия
Оба эффекта (релятивистский и связанный со спин-орбитальным взаимодействием) имеют одинаковый порядок величины:
Квантовое число полного момента импульса j (внутреннее квантовое число) определяет величину квадрата полного момента импульса электрона в атоме
и принимает значения j = l ± 1 / 2 .
Вследствие влияния обоих факторов все уровни одноэлектронного атома расщепляются на два подуровня по числу возможных значений квантового числа j, (s-уровни не расщепляются, j имеет единственное значение j=s = ½). Это расщепление, поскольку его масштаб мал (≈α2E0; α = 1/137), называется тонким расщеплением. Поэтому безразмерная постоянная α, определяющая масштаб расщепления, называется постоянной тонкой структуры. Для водородоподобных ионов (отличающихся от атома водорода зарядом ядра – He+, Li2+, Be3+) необходимо учитывать заряд ядра
Структура спектров водородоподобных ионов аналогичны спектру водорода. Различие состоит в длинах волн линий. При повышении заряда ядра в ряду He+, Li2+, Be3+... увеличивается энергия связи между единственным электроном и ядром, соответственно, увеличивается энергия возбуждения. Сходные закономерности в спектрах можно наблюдать и для других элементов, следующих друг за другом в периодической системе – правило сдвига Косселя–Зоммерфельда. Спектр каждого элемента подобен спектру однократно ионизированного атома элемента, следующего за ним. Эта же закономерность распространяется и на многократно ионизированные атомы. Наблюдается сходство в атомных спектрах в рядах Na, Mg+, Al2+, Si3+, или Al, Si+, P2+, S3+. Энергетическое состояние атома в целом принято характеризовать суммарными квантовыми числами: l – суммарное орбитальное квантовое число, s – суммарное спиновое квантовое число. Численное значение l можно подсчитать как алгебраическую сумму магнитных квантовых чисел ml всех электронов атома. Суммарное спиновое квантовое число s равно сумме спиновых квантовых чисел всех электронов атома. Орбитальное и спиновое числа образуют число j = l+s, или j = l-s (связь Рассела–Саундерса). Электронное состояние атома обозначается специальным символом – термом: nMLj, где n – главное квантовое число, М – мультиплетность.
Существуют правила отбора, разрешающие и запрещающие переходы. В атомных спектрах проявляются не все возможные квантовые переходы, а лишь разрешенные правилами отбора. Так, в случае атома с одним внешним электроном разрешены лишь переходы между уровнями, для которых орбитальное квантовое число / изменяется на 1 , т. е. s-уровни (l = 0) комбинируют с р-уровнями (l=1), р-уровни - с d-уровнями (l = 2) и т.д. Количественная характеристика разрешенного оптического квантового перехода - его вероятность, определяющая интенсивность спектральной линии, соответствующей этому переходу. Вероятность определяет, как часто этот переход может происходить. От вероятностей переходов зависят интенсивности спектральных линий. В простейших случаях вероятности переходов для атомных спектров могут быть рассчитаны по методам квантовой механики. Вероятность переходов, запрещенных правилами отбора, значительно меньше вероятности разрешенных переходов. Линии, отвечающие запрещенным переходам, либо вовсе не появляются в спектре, либо имеют малую интенсивность.
Основные правила отбора:
1. Разрешены переходы, если L меняется на ±1 (т.е. с S уровней на P, с P уровней на D и S, с D на P и F).
2. Разрешены переходы лишь между уровнями одной мультиплетности.
Последнее правило может нарушаться, особенно в спектрах атомов с большим зарядом ядра. Тем не менее, линии, соответствующие запрещенным переходам, оказываются слабее линий разрешенных переходов.
Контрольные вопросы:
1. Виды спектров испускания
2. Как характеризуют спектральные линии?
3. На чем основана систематика спектров атомов с двумя и более внешними электронами?
4. Какие закономерности характерны для лоренцевского уширения линий?
5. Какие существуют правила отбора, разрешающие и запрещающие переходы?